Innføringen av CTIS: - Krevende både for industri og myndigheter
Etter innføringen av det felles-europeiske systemet CTIS er saksbehandlingen av søknader om kliniske studier blitt lengre og mer ressurskrevende.

Det forteller Anette Solli Karlsen, seniorrådgiver ved Enhet for klinisk utprøving og innovasjon hos Direktoratet for medisinske produkter, DMP.
- Saksbehandlingen nå er mye mer krevende for oss – den krever både flere folk og mer tid enn før innføringen av CTIS. Saksbehandlingstiden har økt fra 60 til inntil 106 dager, det er mindre fleksibilitet, strenge frister og til dels strengere krav til dokumentasjon enn tidligere. Spesielt har nok dokumentasjonen som gjelder de nasjonale forholdene blitt vanskeligere for sponsor. CTIS er for eksempel ikke tilpasset studier med komplisert design, sier Karlsen.
CTIS står for Clinical Trials Information System og er et felles digitalt saksbehandlingssystem som ble innført i hele Europa 31. januar 2022. Det er en konsekvens av Clinical Trials Regulation (CTR), som blant annet har som mål å harmonisere saksbehandlingen av klinisk utprøving i Europa, øke sikkerheten til personer som deltar i studier, og sikre åpenhet rundt studiedata.
- CTD = gammelt regelverk (regulert etter Clinical Trials Directive)
- CTR = nytt regelverk (regulert etter Clinical Trials Regulation)
Målet er altså godt, men veien dit er humpete. Innføringen har gitt overgangsutfordringer både for forskere, klinikere, industrien og legemiddelmyndighetene – inkludert DMP.
- Frem til 31.januar 2023 kunne man sende inn søknader etter begge regelverk, men etter denne datoen er det bare mulig å søke i CTIS. Overgangsperioden har vært ekstra krevende både for DMP og for industrien. Alle pågående studier som er sendt inn under gammelt regelverk må søkes overført til nytt regelverk, med såkalte transisjonssøknader, og dette jobber firmaene med for harde livet nå. Det er estimert at cirka 5000 søknader skal overføres fra CTD til CTR. Vi har kommet i land med cirka 20 % nå, så vi er spent på hvordan det neste halve året vil se ut for oss, sier Karlsen.
Trøsten er at det vil gå seg til etter hvert, mener hun.
- At sponsor nå kan sende bare én søknad som gjelder i hele Europa, i stedet for å måtte søke i hvert enkelt land, vil bli en betydelig forbedring. Vi i DMP må heller ikke ta den ansvarlige rollen i hver enkelt utredning, så også for oss blir dette enklere på noen områder, sier Karlsen.
For hver søknad er legemiddelmyndighetene i ett land ansvarlig for utredning (RMS - Reporting Member State), mens øvrige deltakende land er medansvarlig («berørte», MSC – Member State Concerned). I Norge er det DMP og Komiteene for klinisk utprøving av legemidler og medisinsk utstyr (REK KULMU) som skal samarbeide om vurderingen av studiene.
Søknadene er todelt. I del 1, som DMP har koordineringsansvar for, vurderes protokoll, risiko/nytte, tilvirkning og import, merking osv. REK KULMU og DMP gjør en samlet vurdering av part 1 på vegne av Norge. I del 2, som REK KULMU har ansvar for, vurderes samtykkeskriv, rekruttering, personvern, hvorvidt utprøverstedet er egnet, bruk og lagring av biologisk materiale mm.
Man kan sende inn del 1 uavhengig av del 2, men hvis man har noe pågående i CTIS fra før, må man vente med å sende inn del 2 til alle tidligere prosedyrer er ferdig behandlet. Det er ikke teknisk mulig å legge inn noe underveis i prosedyren. På grunn av dette sender de fleste inn begge deler samtidig.
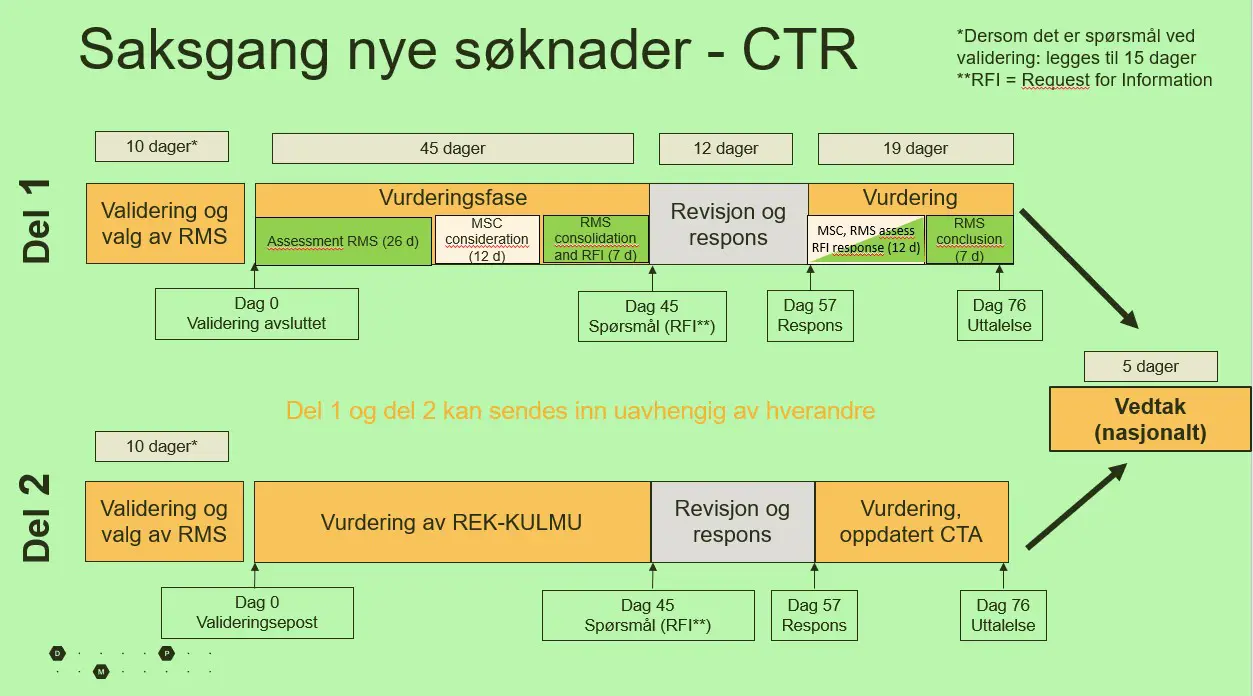
Alt skal altså vurderes innen et bestemt antall dager.
- Alle helligdagene til ansvarlige utrederland (RMS) skal hensyntas, så med ulike helligdager og fridager i ulike land blir tidsfristene til sammen veldig lange. Dersom sponsor svarer før fristen deres på 12 dager, må vi svare innen våre tilmålte 19 dager fra den dagen de har svart. Hele prosessen krever mye av både oss som myndigheter og av sponsor. Vi har likevel tro på at dette vil gå seg til etter hvert, og bli lettere både for oss og for firmaene, sier Karlsen.
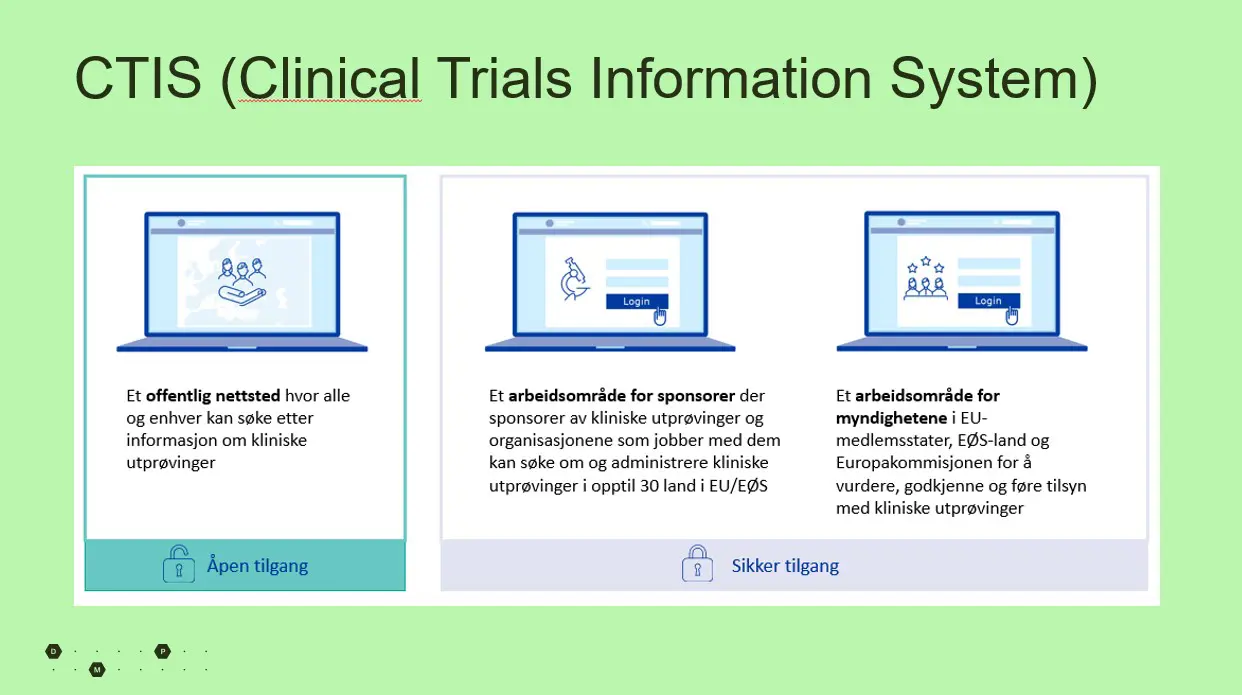
Bildetekst: CTIS er et offentlig nettsted hvor hvem som helst kan søke etter informasjon om kliniske utprøvinger som er godkjent av legemiddelmyndighetene. I tillegg finnes et sikkert område av CTIS der sponsorer og myndighetene jobber. Det er den sistnevnte delen som omtales i denne artikkelen.